Colecta de hembras de mosquitos con ingesta de sangre en sitios con superabundancia de un vertebrado.
Cardo María V [1][2], Melgarejo-Colmenares K [1][2], Kliger M, Vezzani, D [2][3].
[1] IIIA-UNSAM-CONICET, Instituto de Investigación e Ingeniería Ambiental, Escuela de Hábitat y Sostenibilidad, San Martín, Provincia de Buenos Aires, Argentina.
[2] Consejo Nacional de Investigaciones Científicas y Técnicas, Buenos Aires, Argentina.
[3] Instituto Multidisciplinario sobre Ecosistemas y Desarrollo Sustentable, UNCPBA-CICPBA, Tandil, Provincia de Buenos Aires, Argentina.
Por qué es importante estudiar la ingesta sanguínea de mosquitos
Las enfermedades transmitidas por mosquitos (Diptera: Culicidae) son un gran problema de salud pública a escala global. La emergencia, dispersión y mantenimiento de los patógenos que causan estas enfermedades depende de la convergencia en espacio y tiempo de los mosquitos vectores y sus hospedadores. Las hembras de mosquitos pican para obtener proteínas y lípidos de la sangre, esenciales para su reproducción. En este contexto, el grado de contacto vector-hospedador a través de la ingesta de sangre cumple un papel fundamental en los ciclos de transmisión de enfermedades en ambientes urbanos y silvestres.
Qué hicimos
Colectamos hembra de mosquitos con sangre en su abdomen en entornos con sobreabundancia permanente de una especie de vertebrado específica, e identificamos a qué especies de vertebrados picaron parte de las hembras colectadas a través de técnicas moleculares. “Fijar” la oferta de hospedadores nos permitió caracterizar los sitios a través del vertebrado mayoritariamente presente, para evaluar patrones de ingesta sanguínea de las especies de mosquitos de importancia sanitaria.
Cómo lo hicimos
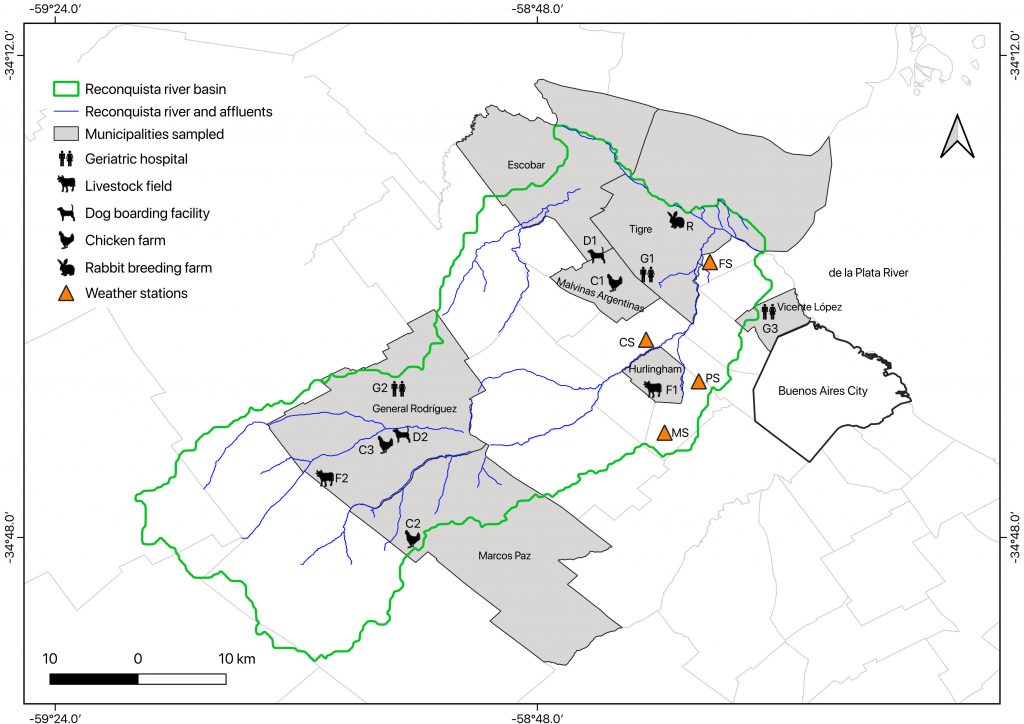
Entre noviembre de 2021 y abril de 2022, se recolectaron mosquitos con aspiradora-mochila en 11 sitios ubicados en seis municipalidades dentro de la cuenca del río Reconquista. Los sitios se categorizaron en cinco tipos de entornos: campos ganaderos (2), granja de cría de conejos (1), granjas de pollos (3), clubes caninos (2) y hospitales geriátricos (3), caracterizados por la sobreabundancia permanente de vacas, conejos, pollos, perros y humanos, respectivamente (Figura 1).
1) Trabajo de campo:
Entre las 7:00 y las 16:00 horas, se realizó una búsqueda activa de hembras de mosquitos en áreas de descanso naturales y artificiales ubicadas en interiores y exteriores. Estos lugares incluyeron establos de ganado, cobertizos, jaulas de animales, oficinas, galerías, áreas comunes (oficina de administración) y vegetación. En cada sitio, se realizaron entre seis y ocho aspiraciones con una duración de 5 min cada una. Los ejemplares colectados fueron transportados en freezer portátil de 12 V a 5-10 ºC al laboratorio de entomología del Instituto de Investigación e Ingeniería Ambiental (3iA) – III (UNSAM-CONICET).
2) Actividades de laboratorio:
a) Procesamiento de mosquitos: Las hembras con sangre en el abdomen fueron separadas por campaña/sitio e identificadas a nivel de especie utilizando claves dicotómicas específicas para la región (Rossi et al. 2002). Luego, se transfirieron individualmente a microtubos estériles de 1.5mL con alcohol 96% y conservadas a -20 ºC hasta la realización de los estudios moleculares.
b) Identificación de la ingesta de sangre: El ADN del hospedador fue aislado de hembras individuales con ingesta de sangre usando un protocolo HotShot (Truett et al. 2000). El análisis de la ingesta de sangre se realizó mediante PCR y secuenciación.
Qué encontramos
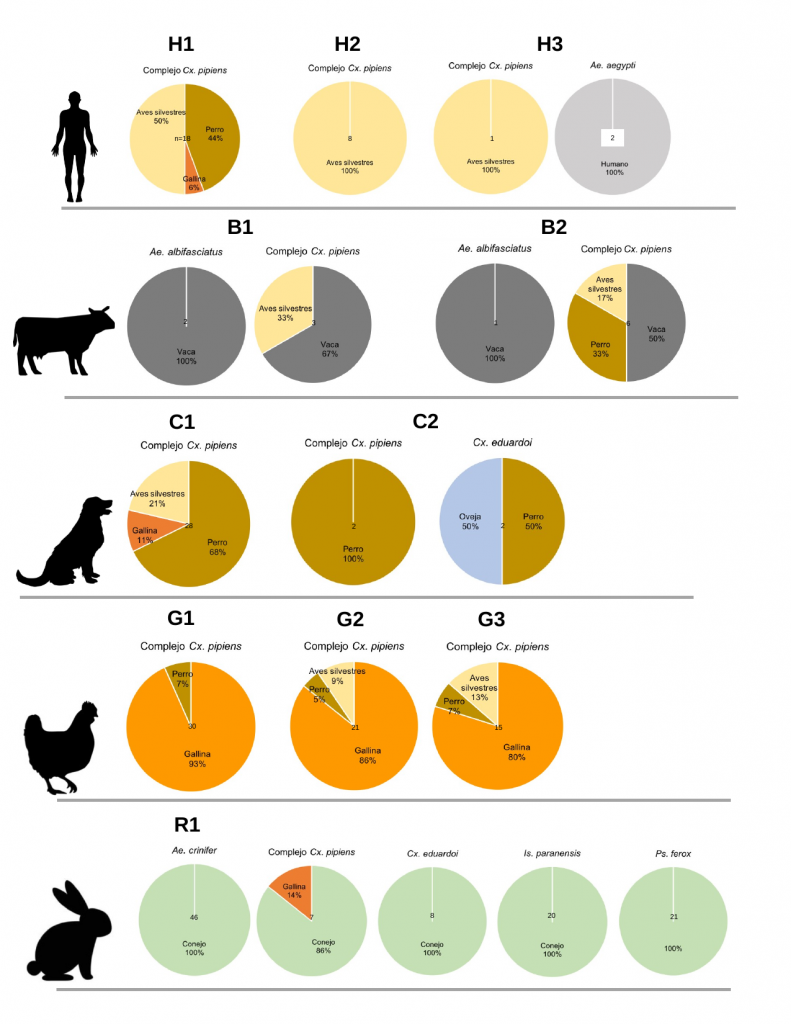
En total, se colectaron 1.636 hembras de mosquitos con ingesta de sangre. El 88% (1.434) de las mismas pertenecieron al complejo Culex pipiens y fueron colectadas en todos los entornos. Los ejemplares restantes se distribuyeron entre 3 especies del género Aedes, 2 de Culex, 1 de Isostomyia y 1 de Psorophora. Entre los entornos muestreados, el número de especies colectadas con ingesta de sangre fue mayor en la granja de cría de conejos (6), intermedio en hospitales geriátricos (4) y clubes caninos (3) y mínimo en campos ganaderos y granjas de pollos. Respecto a las especies registradas, Aedes crinifer, Isostomyia paranensis y Psorophora ferox fueron colectadas exclusivamente en la granja de cría de conejos. Los especimenes de Aedes aegypti solo se colectaron en hospitales geriátricos.
Se identificó sangre de 17 especies de vertebrados (5 mamíferos, 12 aves). Las ingestas sobre mamíferos representaron el 61% del total y correspondieron a humano y a especies domésticas: perro, vaca, conejo y oveja. Las dos ingestas de sangre de humano fueron identificadas en ejemplares de Ae. aegypti, en línea con las epidemias actuales del virus del dengue y Chikungunya en Argentina (BEN, 2024).
De las 12 especies de aves identificadas como hospedadores, ocho han sido encontradas infectadas naturalmente con el virus del Nilo Occidental y/o encefalitis de St. Louis (Díaz et al. 2018). Entre las 93 muestras identificadas, 63 correspondieron a Gallus gallus y 30 a especies silvestres.
De las especies de mosquitos registradas en el presente estudio, Ae. aegypti, Ae. albifasciatus, Ae. crinifer, Cx. pipiens y Ps. ferox son reconocidas como vectores efectivos o potenciales de enfermedades establecidas o emergentes en la región. Respecto a Cx. eduardoi y Is. paranensis, de las cuales se desconoce su rol potencial en la transmisión de enfermedades, es igualmente importante obtener información de la fuente de ingesta sanguínea a escala local. Nuevas enfermedades vectoriales emergen constantemente en distintas regiones del globo y para muchas de ellas se desconocen los ciclos de transmisión, incluidos sus vectores.
Bibliografía
BEN (2024). Boletín Epidemiológico Nacional N° 703, Semana Epidemiológica 18. Argentina: Ministerio de Salud.
Díaz, A. Flores, F.S. Quaglia, AI. Contigiani, M.S. (2018). Evaluation of Argentinean bird species as amplifying hosts for St. Louis Encephalitis Virus (Flavivirus, Flaviviridae). The American journal of tropical medicine and hygiene. 99, 216–221.
Rossi, G.C. Mariluis, J.C. Schnack, J.A. Spinelli, GR. (2002). Dípteros vectores (Culicidae y Calliphoridae) de la Provincia de Buenos Aires. Buenos Aires: Secretaría de Política Ambiental y Universidad de La Plata.
Truett, GE. Heeger, P. Mynatt, R.L. Truett, A.A. Walker, J.A. Warman, M.L. (2000). Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29, 52–54.